精准药物筛选迎来新突破!Int J Biol Macromol:新型水凝胶助力肝癌类器官培养,为个性化药物筛选和疗效评估提供新策略
来源:生物谷原创 2024-11-12 13:15
结果显示,透明质酸/海藻酸盐双网络水凝胶(HADR)与肝脏生理力学相兼容,促进了细胞的粘附与增殖,肝癌类器官的耐药性强于2D培养,且水凝胶营造了类似天然肿瘤微环境,DOX治疗能够抑制细胞相关活动
肝癌作为全球范围内常见且极具致命性的恶性肿瘤,其抗癌药物开发的失败率颇高,原因之一在于临床前模型难以精准反映体内药物反应等状况。常用的临床前模型,如二维培养模型和动物模型,与人体肿瘤微环境存在较大差异且具有诸多缺陷,这促使基于生物材料的肝癌类器官得以发展,因其能够模拟肿瘤细胞在体内的情况,为药物筛选等提供了平台。细胞、生长因子和支架材料是类器官构建的关键要素,其中支架材料尤为重要。Matrigel的应用受到限制,而多功能水凝胶则更具优势,众多研究通过调控其物理力学性质来影响细胞行为,进而模拟细胞外微环境。透明质酸是水凝胶的关键资源,但存在易降解等不足之处,双网络水凝胶备受关注,因其通过特殊交联结构在变形时具备良好性能。多巴胺和RGD序列可提升水凝胶的生物活性,然而将兼具优异机械性能和良好生物活性的水凝胶用于肝癌类器官的报道较为少见。
近日,华东理工大学蔡海波研究团队在Int J Biol Macromol发表了题为A chemically defined, mechanically tunable, and bioactive hyaluronic acid/alginate double-network hydrogel for liver cancer organoid construction的研究论文。该团队设计了以透明质酸(HAMA)、海藻酸盐(SA)等材料构成的透明质酸/海藻酸盐双网络水凝胶(HADR)用于肝癌类器官培养,并对细胞外基质参数进行了优化。结果显示,HADR水凝胶与肝脏生理力学相兼容,促进了细胞的粘附与增殖,肝癌类器官的耐药性强于2D培养,且水凝胶营造了类似天然肿瘤微环境,DOX治疗能够抑制细胞相关活动。本研究证明了HADR水凝胶的潜力,为个性化药物筛选和疗效评估提供了新策略。

水凝胶的制备和表征
细胞外基质的机械信号对细胞的扩散、生长等过程具有重要影响。本研究通过频率扫描评估水凝胶的粘弹性,结果表明其储能模量和损耗模量稳定,显示结构完整。制备了不同含量的SA和HAMA的双网络水凝胶,发现引入SA和增加HAMA浓度可提高水凝胶的储能模量、损耗模量及刚性。通过压缩和拉伸试验评估机械强度,加入SA后水凝胶的压缩应力和模量大幅提升,HADR水凝胶的断裂应力和应变对SA浓度呈单调依赖。为匹配人体肝脏组织生理力学性能,选择2%的HAMA和1%的SA用于后续水凝胶制备。
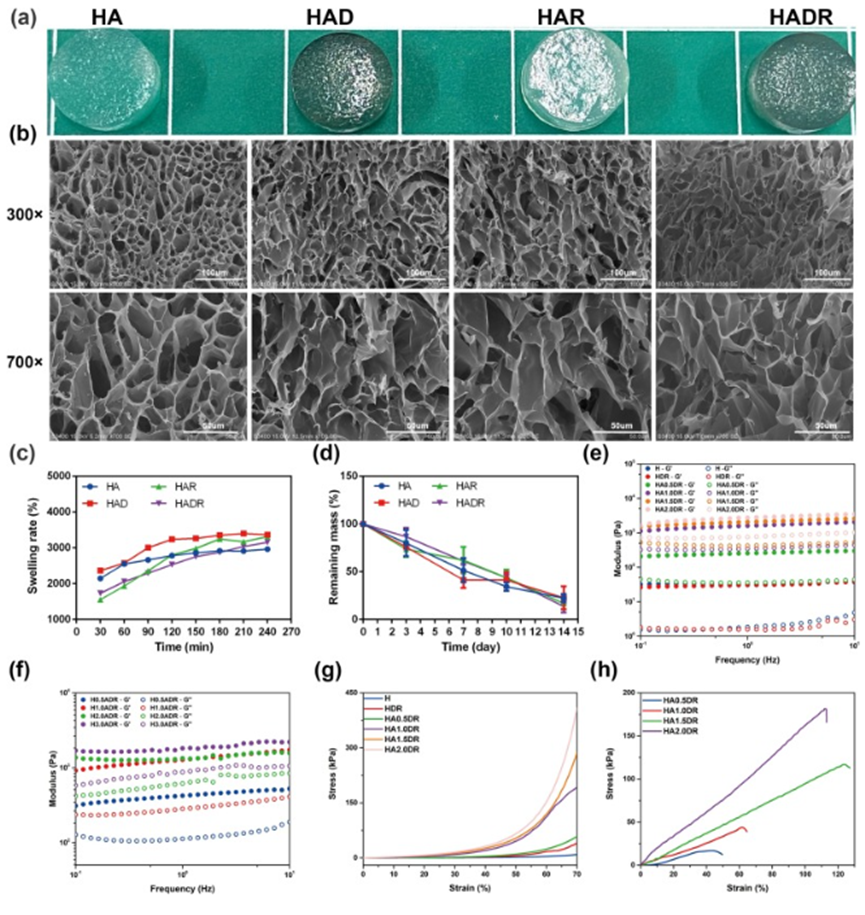
图1. HA、HAD、HAR和HADR水凝胶的形态和力学表征
细胞在水凝胶上的黏附和增殖
细胞黏附对于决定细胞命运至关重要,因其能够触发细胞增殖、迁移和分化等重要过程。为解决透明质酸和海藻酸钠抗拒蛋白质吸附及细胞黏附的问题,研究评估了不同浓度的DMA、c(RGDfC)及其协同作用对基于透明质酸的水凝胶细胞黏附性能的影响。基于透明质酸水凝胶,制备了DMA含量为0.05-0.15 wt%的一系列水凝胶(命名为HADn,n表示DMA含量)。对DMA的BCA分析显示,DMA浓度增加,酚羟基含量相应上升,导致HAD水凝胶在562 nm处吸光度更高。通过活/死染色检查不同DMA水平对细胞黏附的影响,与透明质酸水凝胶相比,HAD水凝胶细胞黏附更优,但不同DMA浓度的HAD水凝胶间细胞黏附无显著差异,可能是因为DMA驱动的黏附主要源于酚羟基与细胞表面的非特异性相互作用,仅提供初始附着。
此外,研究了HAD水凝胶的自由基清除能力,其对减轻细胞内氧化应激至关重要。HAD水凝胶表现出强自由基清除能力,主要归因于DMA中的儿茶酚基团。透明质酸水凝胶自由基清除率为10.24±0.44%,而HAD 0.15水凝胶为92.14±0.043%,约为透明质酸水凝胶的9倍。
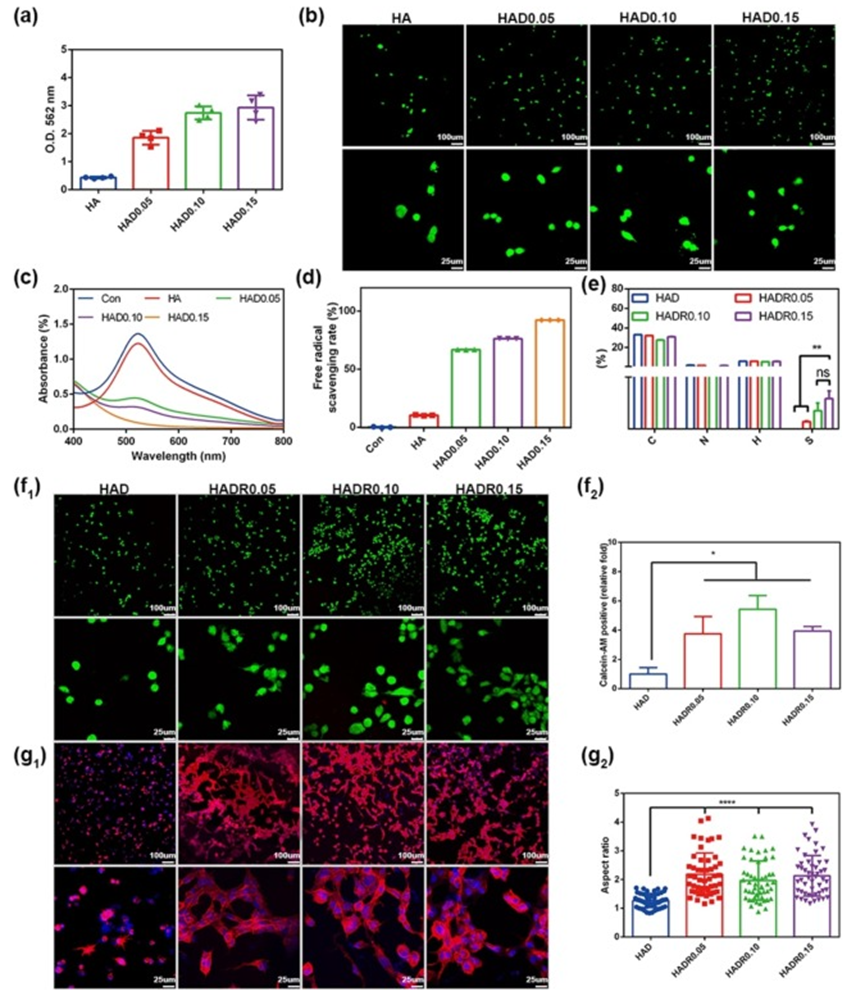
图2. DMA和c(RGDfC)对水凝胶细胞粘附能力的影响
水凝胶的生物相容性
生物相容性对于使用生物材料模拟肝脏细胞外基质环境至关重要。研究通过体外溶血试验、细胞毒性测定和小鼠全层皮肤缺损模型评估HADR水凝胶的生物相容性。溶血试验表明所有组的溶血率均低于5%,与水凝胶共培养后细胞活力未下降,说明水凝胶不引起溶血,具有良好的细胞相容性。进一步通过H&E染色、Masson染色和CD68染色评估其体内生物相容性。将水凝胶应用于小鼠背部全层圆形伤口,在第7和14天采集皮肤样本。
第14天,水凝胶处理的伤口愈合率超87.42±8.23%,有完整上皮化和皮肤附属器形成,与对照组相似。第7天,H&E染色显示水凝胶处理伤口有更多肉芽组织和微血管化。第14天,所有组小鼠背部皮肤伤口与健康皮肤组织相似,有更丰富血管网络和厚且完整上皮层。Masson染色显示第14天切口处胶原纤维排列更致密有序,有皮肤附属器再生。CD68染色表明各实验组炎症反应相似且随伤口愈合降低,说明水凝胶不加剧炎症,具有出色生物相容性。
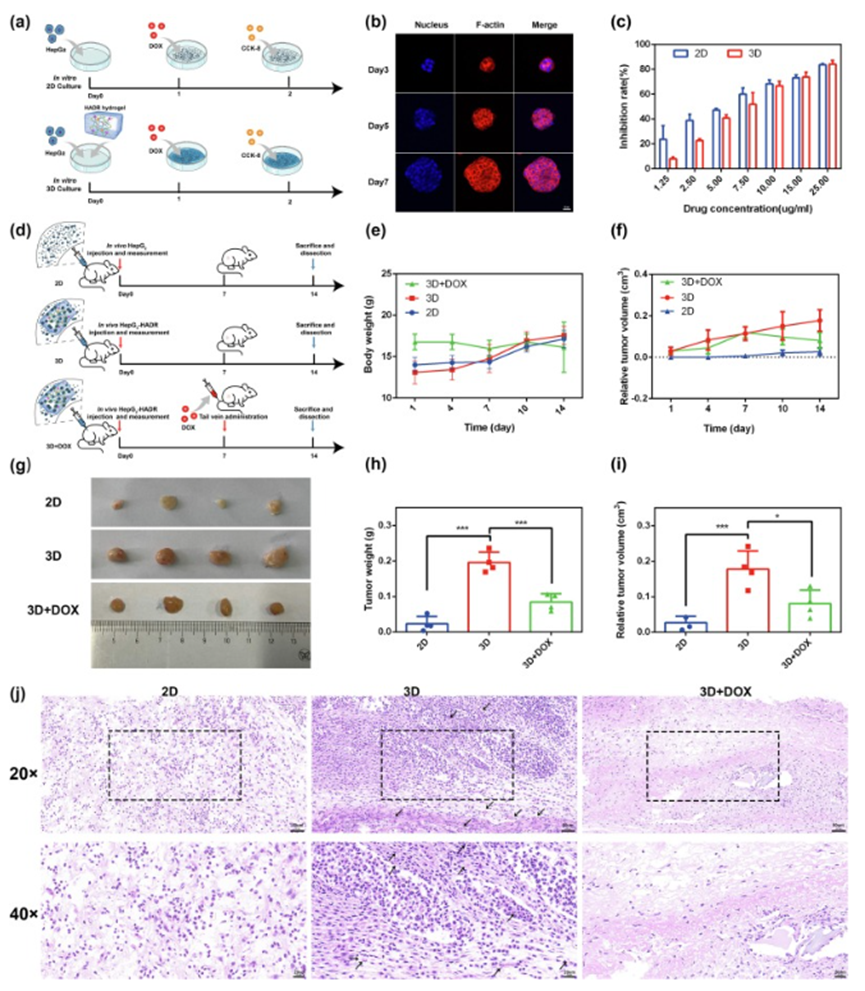
图 3. 基于HADR水凝胶的HepG2细胞系来源的肝癌类器官的体外和体内构建
HepG2细胞系来源的肝癌类器官的构建
以肝细胞系HepG2为模型细胞在HADR水凝胶中培养构建肝癌类器官。通过评估DOX抗肿瘤效果考察HADR水凝胶对肿瘤生长和药物治疗的影响。HepG2细胞在2D培养皿和3D水凝胶中表现不同,3D水凝胶中形成不规则多细胞聚集体且细胞生长良好。DOX对2D和3D条件下肝癌类器官的IC50值不同,3D水凝胶中肿瘤对DOX抗性更高因其多孔结构更类似生理微环境。建立皮下荷瘤裸鼠模型,分为2D、3D、3D+DOX组,监测体重和肿瘤体积,14天后分析肿瘤,3D组肿瘤最大,3D+DOX组肿瘤受抑制。H&E染色显示3D组类似体内环境,3D+DOX组细胞损伤明显。免疫组化染色表明3D组Ki-67表达高、MMP-9阳性细胞多,3D+DOX组则相反,说明DOX有抗肿瘤作用且抑制细胞侵袭转移能力,HADR水凝胶和DOX对器官安全。
总之,本研究成功开发出与人体肝脏生理力学性能匹配且支持多种细胞黏附和增殖的透明质酸/海藻酸盐双网络水凝胶(HADR)。小鼠全层皮肤缺损模型表明该水凝胶不加剧炎症,具有出色的生物相容性。随后以HepG2细胞为模型细胞,基于HADR水凝胶构建肝癌类器官(3D)。
体外药物疗效评估显示3D组比2D培养表现出更强的耐药性。体内药物疗效评估表明DOX通过抑制HepG2细胞的增殖、侵袭和转移对皮下肿瘤发挥抗肿瘤作用,证明了该模型在评估药物疗效方面的可靠性和有效性。该研究为构建肝癌类器官提供了潜在的生物支架材料,支持在科研和药物开发中减少或替代实验动物。(生物谷Bioon.com)
参考文献:
Zhao Y, Gong J, Liu H, Huang H, Tan WS, Cai H. A chemically defined, mechanically tunable, and bioactive hyaluronic acid/alginate double-network hydrogel for liver cancer organoid construction. Int J Biol Macromol. Published online October 21, 2024. doi:10.1016/j.ijbiomac.2024.136707
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


